医药学术增添的道理医疗学医疗学术沙龙
中国医药行业处于“仿造药策略”向“改进药策略”的转型要害期,国度出台多项计谋激动改进药
学术推广
学术推广
中国医药行业处于“仿造药策略”向“改进药策略”的转型要害期,国度出台多项计谋激动改进药研发,搜罗临床试验数据核查、药品上市许可持有人轨造、加快改进药审评审批等五大宗旨,本文将对其举行深度解读。
医药,正在环球具有万亿墟市,这里成立了辉瑞、强生、阿斯利康等繁多国际造药企业巨头。它们不只坐褥药物,况且不绝研发始改进药,为攻下人类疑义病症奉献颇多,同时企业得回相当可观的经济回报。中国的医药墟市中,同样存正在恒瑞、正大天晴、扬子江药业等器从头药研发的造药企业。然而,中国群多半药企以坐褥仿造药为主,研发认识与加入低,改进材干弱。
2015年往后,国务院、卫计委、食药监局、发改委等多个国度级部分汇集宣布医药研发联系计谋,厉厉表率新药审批流程,赐与改进药诸多优惠计谋,以期胀舞国内药企从“仿造药策略”向“改进药策略”转型。陪伴欧美等兴隆经济体不停范围或缩减医疗卫生预算,以及新药研发本钱的不绝攀升,医药研发的“阵脚”开端转向中国、亚太地域及拉丁美洲等其他国度和地域。咱们能够猜念,中国将迎来医药研发改进的黄金工夫。
总体来看,计谋首要从五个宗旨胀动以改进力为中枢的医药研发经过,可详细为五概略害词:临床试验数据核查,药品上市许可持有人轨造,加快改进药审评审批,激动优质改进药品与国际接轨,配套计谋提质地、促改进。
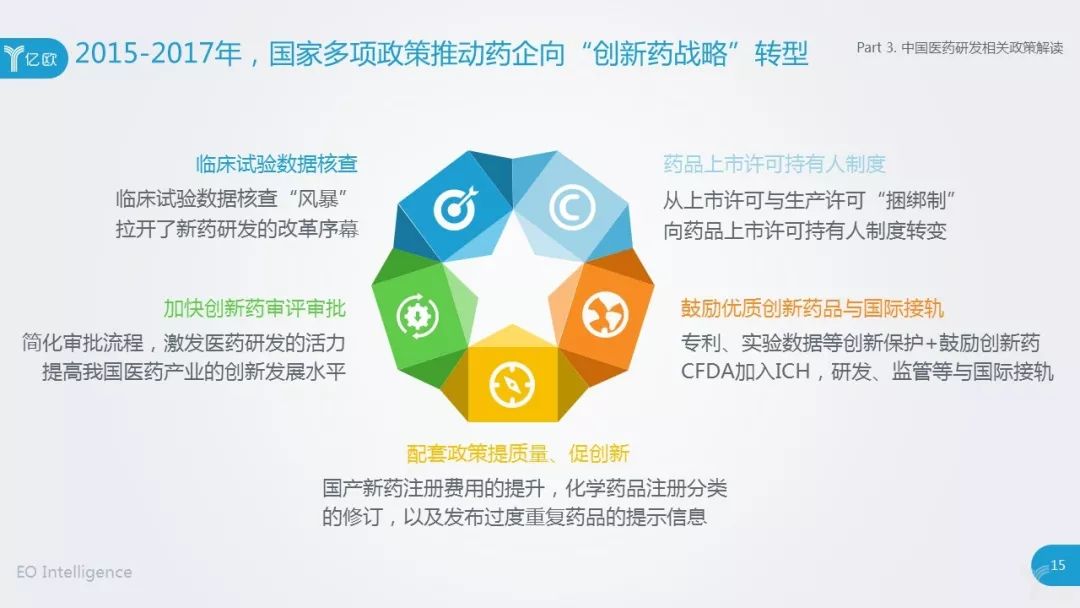

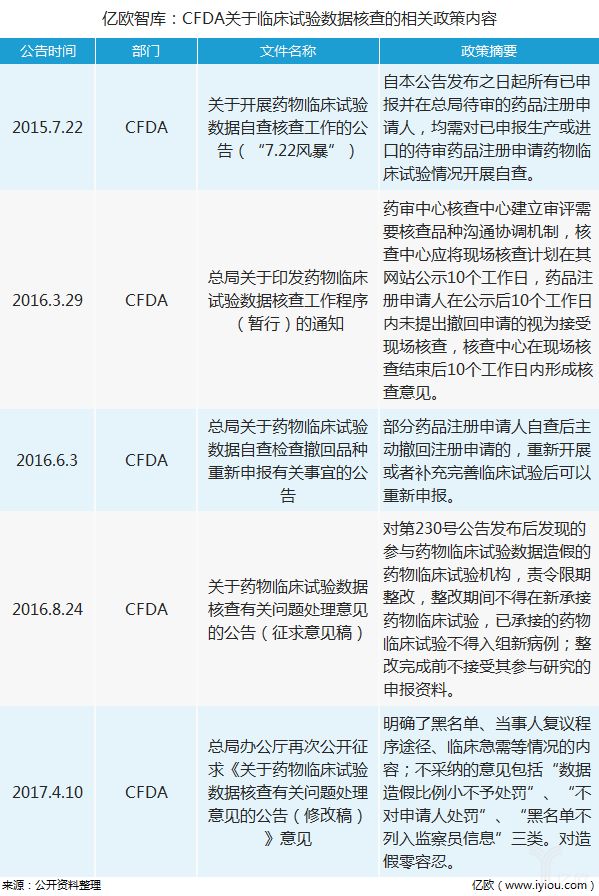
2015年起,CFDA正在国内医药行业掀起了临床试验数据核查“风暴”,重办用意造假,应承表率补正,从而正式拉开了新药研发的厘革序幕。此次核查中,进步七成的申报药物被撤回,暴显露来的题目也足够证据国内药企研发加入认识不敷,中国研发加入唯有环球研发加入的5%把握,仅辉瑞一家企业的研发加入就相当于国内世界医药企业的研发加入还多。
自此次核查“风暴”往后,药企特别器重临床试验的品格,促使其采取更优质的CRO企业,同时也鼓励了国内CRO企业提拔临床试验秤谌,代价战大局取得旋转。

我国正正在始末药品注册轨造厘革,即从上市许可与坐褥许可“系结造”,向药品上市许可持有人轨造蜕化。过去所实行的“系结造”存正在诸多坏处,搜罗:
第一,药品研策动力不敷。因为上市许可和坐褥许可系结正在一道,为把研发功效转化为可运用的医药产物,研发者或投资筑厂,从而导致本钱增大,无力再从事其他新药探求;或寻求短期长处,举行技能让与,从而不再眷注药品的进一步校正和完竣;乃至再有少少研发者采用“暗箱操作”的本事私自多次让与、分段让与或“反复研发”,导致药品研发低秤谌反复和改进乏力等一系列题目。
第二,行业资源设备效劳低下。坐褥企业为寻求墟市效益,不绝夸大药剂坐褥的种类或修筑新的坐褥线,从而酿成药品坐褥反复修筑和坐褥摆设闲置率过高的乌有“繁华”;更有少数企业以剂型、包装、规格等差异为由反复申报接受文号,酿成上市许可漫溢和空置,影响我国造药行业的良性有序生长和改进。
第三,联系主体权责不清。现行许可轨造并未分明界定药品坐褥者、筹备者和医疗机构等联系主体的公法负担,导致其各管一段,没有对药品格地正在其一切人命周期永远肩负全责的主体。越发是现行轨造没有清楚章程研发者的公法负担,导致研发者以技能让与为由将质地负担转化至坐褥企业,从而使药品格地无法自始至终地取得相同性保险,更无法有用地酿成上市后药品不良反响的监控和校正。
第四,当局行政资源挥霍。“系结”监禁固然一经起到了厉厉监禁的功用,但因为该轨造内正在的不敷,导致监禁部分把巨额资源挥霍正在低秤谌反复申报的审评审批上,无法酿成有用的药品全人命周期的监禁,无力胀舞药品工业改进,也难以扶植科学、有用的药品监禁体例。
2015年8月,正在《国务院合于厘革药品医疗器材审评审批轨造的见解》之中,提出“展开药品上市许可持有人轨造试点,落实申请人申报主体负担”。2017年10月,国度食物药品监禁总局办公厅公然包括《〈中华黎民共和国药品处分法〉删改案(草案包括见解稿)》见解,个中一条为“一共施行药品上市许可持有人轨造”。
药品上市许可和坐褥许可折柳的处分形式有帮于研发者得回和鸠集资金、技能和人力举行陆续探乞降新药研发,有帮于清楚和深化研发者正在药品研发、坐褥、流利和运用的一切周期中承受相应的公法负担,促使其不绝校正和完竣技能,保险药品安静,抬高药品格地。

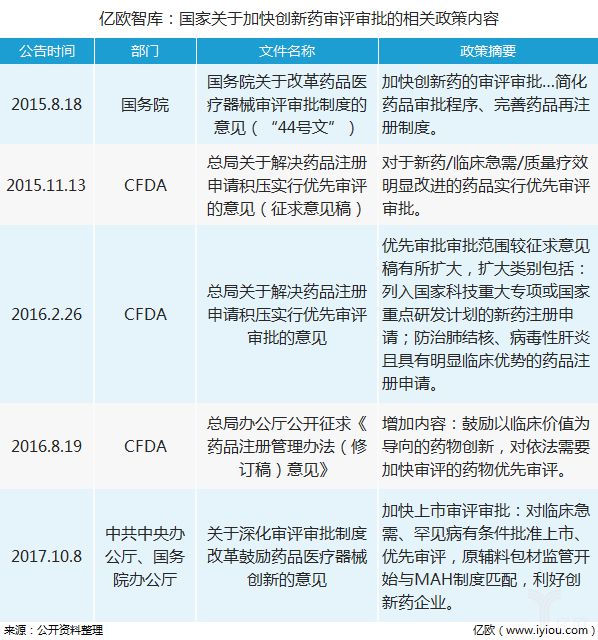
2015-2017年,多项国度计谋文献中提出,要加快改进药审评审批,以缩短审评审批流程。加快临床急需等改进药械上市程序,一批新药优先获准上市。该计谋被以为是“开国往后医药行业的最巨大计谋”,其关于激励医药研发的生气,抬高我国医药工业的改进生长秤谌,处置临床急需药品欠缺困难拥有要紧的意旨。
正在该计谋胀舞下,江苏恒瑞医药股份有限公司申报的新药“马来酸吡咯替尼”,因拥有显着临床上风被总局药审核心纳入优先审评名单。据不统全盘计,2016-2017年,已先后有23批近300个药品注册申请进入优先审评序次。

以临床价格为导向的药物研发,是国度重心激动的宗旨。简直而言,国度出台了专利爱戴、临床试验数据爱戴、国度职责职员保密负担、表率学术引申活动、支撑中药传承和改进等多项实质。
2017年6月,CFDA正式插手ICH(International Council for Harmonization,人用药品注册技能请求国际融合集会),记号着国际社会对中国当局药品审评审修正革和中国医药工业的认同,有利于中国医药行业正在研发、监禁等各方面与国际接轨。同时,这将胀舞国际改进药品早日进入中国墟市,餍足临床用药需求,同时提拔国内造药工业改进材干和国际比赛力。

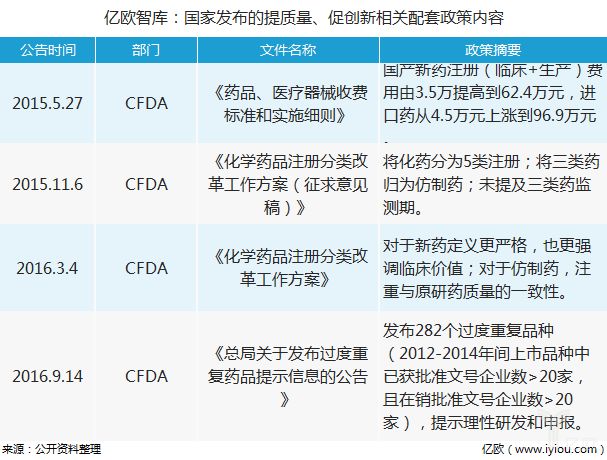
除了上述计谋表,国度食物药品监视总局还出台了一系列配套计谋,以提拔研发药物的质地,鼓励新药研发。个中搜罗对国产新药注册用度的提拔,化学药品注册分类的修订,以及宣布太过反复药品的提示音信,以表率药企研发价格导向。
比方,2015年国产新药注册(临床+坐褥)用度由3.5万抬高到62.4万元,进口药从4.5万元上涨到96.9万元:药品注册收费圭臬的大幅提拔,一方面是与国际接轨迈出第一步(调动后的收费圭臬,仅相当于澳大利亚的64%,加拿大的35.5%,美国的5.2%和日本的33.7%),另一方面临于整顿仿造药产能首要过剩的国内近况,抬高仿造药具体秤谌有着主动的功用。
以上是亿欧智库通过五个要害词,对2015-2017年间国度宣布的一系列医药研发联系计谋的解读。该实质节选自《2018中国医药研发改进探求讲演》,明了更多实质接待





